-
[효모 배양 및 스톡 제작]실험방법 2024. 9. 12. 10:02
석사 연구 중 졸업논문 주제와 개인적인 과제주제 중
B.C제작이 겹쳤다.
하지만 나 나칠라....
회사에서 죽어라 대장균군 배지만 만들어 봤기에
다른 건 너무 어렵다...
그래서 다양한 논문과 다른 방의 석사과정생 학우님들의
지식에 도움을 받았다.
이 글은 내가 까먹지 않고
잘 보관해 두려는 목적이 크다!
틀린 점이 있으면 당신이 맞으니
저도 가르쳐 주세요ㅠㅠㅠ
효모 배양
엥? B.C 만든다면서 효모는 왜...?
할 수 있지만!
연습용으로 효모를 키우고 스톡까지 해볼까 한다.
실험방법(빠른 설명)
1. 효모배지 만들기(YPD 및 YPDA)
2. 1번 배지에 효모 균주(스트레킹) 및 배양
3. 4번 하기 전에 YPD액체배지 만들기
4. 배양 완료한 배지에서 단일 콜로니를 채취하여 액체배지에 균주 및 진탕배양
5. 진탕 배양 완료한 배지(전배 양)에서, 50% 글리세롤을 용기에 넣어 동결건조상세설명

YPD & YPDA 배지 만들기
(시판에 나와 있지만, 나는 만들어서 사용)
YPDA / YPD 만드는 방법 "Difco™ YPD Broth"의 레시피를 참고
필요한 재료
- 효모추출물 (Yeast Extract): 10g
- 펩톤 (Peptone): 20g
- 덱스트로즈 (Dextrose, 포도당): 20g
- 정제수: 1L
- 아가: 15g (일반 PDA 만드는 과정 참고)
제조 방법
1. 혼합: 정제수 1리터에 효모추출물 10g, 펩톤 20g을 첨가한다.2. 포도당 멸균: 덱스트로즈 20g을 별도로 정제수에 용해시킨 후, 오토클레이브를 사용하여 121°C에서 15분간 멸균한다.
3. 혼합 및 용해: 모든 성분이 포함된 정제수를 잘 섞어 성분들이 완전히 용해될 때까지 교반 한다.4. 최종 혼합: 멸균된 포도당 용액을 나머지 혼합물에 첨가하고 잘 섞는다.
5. 냉각: 최종 혼합물을 상온에서 식힌다.6.pH 조정: 최종 pH는 6.5±0.2로 조정한다. 필요하다면 pH를 조절하기 위해 적절한 버퍼(예: 0.1N 염산 또는 0.1N 수산화나트륨)를 추가한다.
7. 보관: 사용하지 않는 배지는 멸균된 용기에 넣어 밀폐하고 냉장 보관한다. 사용하기 전에 다시 가열하여 사용할 수 있다.
여기서 포도당 멸균과 PH조절은 필수사항이 아니라서 ---로 표시했다.
이 과정을 진행해도 좋지만 안 해도 무방하다고 들었다.



오토클레이브 돌릴 때,
저 스티커를 붙이면
오토클레이브가 잘 작동했는지
알 수 있어 정확한 실험을 할 수 있다.


YPDA 만들기

옆방에서 받은 효모 스톡
필요
-스톡샘플
-백금이
-배지
-생물안전작업대
-배양기 등
실험 방법
1. 받은 스탁을 녹인다. (상온에서 몇 분 정도 / 흔들어보면 다 녹은 거 확인 가능)
2. YPDA에 3단 스트레킹
3. 1일 30 ºC 배양

5시간 배양 
28시간 배양
A배지
흠... 1차 실패
(회사에서 황포 할 때, 잘한다고 생각했는데
자만하다가 이런... 일이..ㅜㅜㅜ)
그래서 다른 날 다시 시도함.
문제점: 스트레킹 할 때, 1단에서 2단으로 못 끌고 옴.


B배지
흠... 2차 실패
문제점: 1차 실패 시, 요란하게 소독한 것이 문제였는 듯...
효모가 아닌 다른 잡균이 자라 버림...
소독은 요란하게 했는데 오염이...
C배지
3차 실패
사진이 없는데, 이건 만들고 배양했는데
공사 아저씨가 배양기 코드를 뽑아버림...
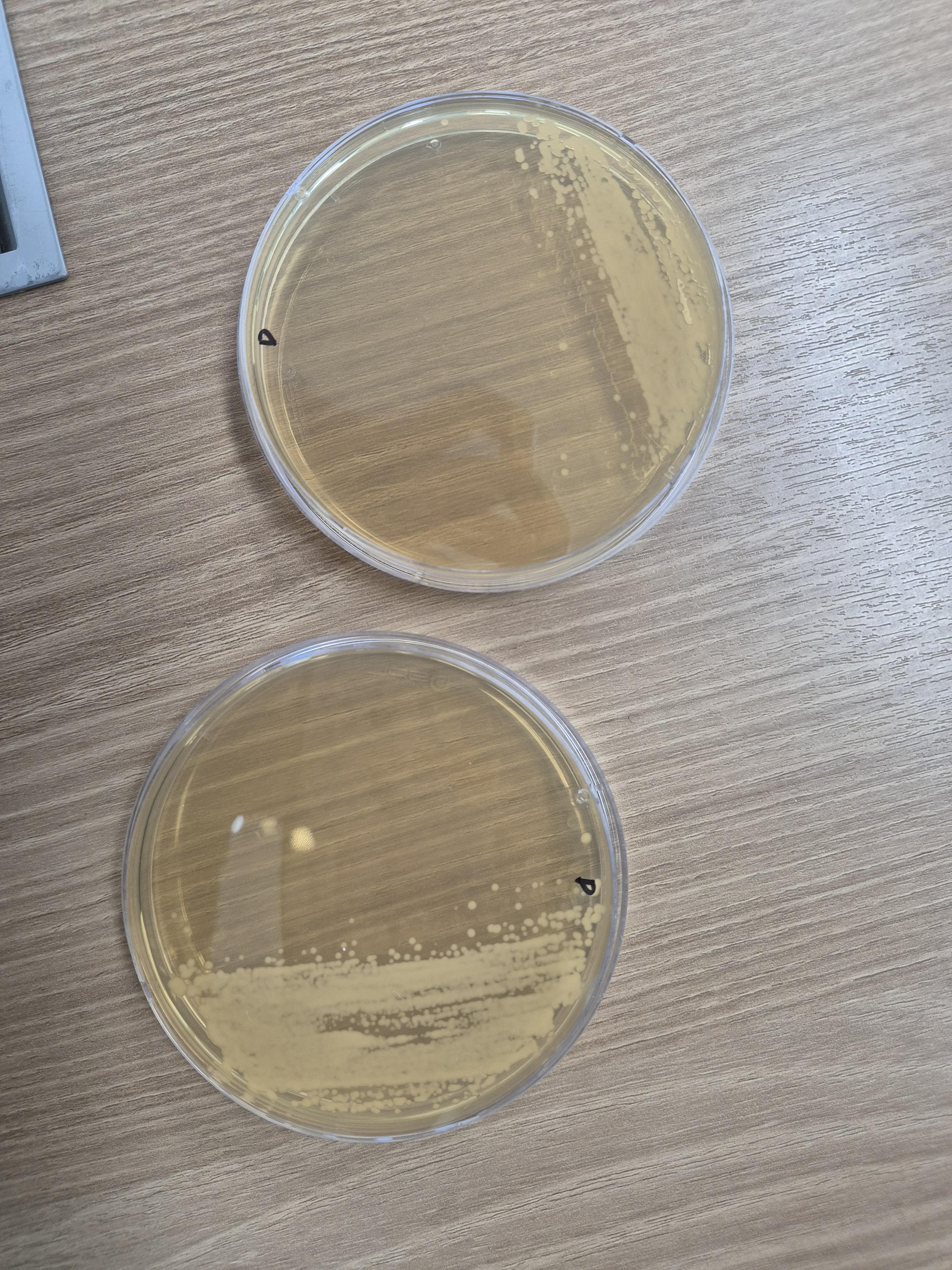
D배지
이것도 솔직히 1단에서 2단으로
스트레킹을 제대로 못 끌고 왔지만
총 10개 플레이트 중
몇 개는 단일 콜로니깐 떠서 그걸로 진행.
전배 양 (및 확대배양)
필요
-백금이
-유리실험관
-실리스토퍼
-진탕배양기
실험 방법
1. 단일 콜로니 떼서 YPD 액체 배지에 접종 (5ml에 1 콜로니 넣기)
2. 16시간 이상 150 rpm 배양 (정적배양이 가능하나 흔드는 것이 골고루 잘 섞여 좋다고 함)
3. (활성화) 확대배양 / (더 많은 균주를 원할 때)
YPD를 100ml 플라스크에 50ml의 broth를 넣고 전배 양 5%를 접종한다고 함.
(전배 양을 접종할 때 볼텍싱해서 접종) 50*5%=2.5 7. 24시간 30 ºC 배양
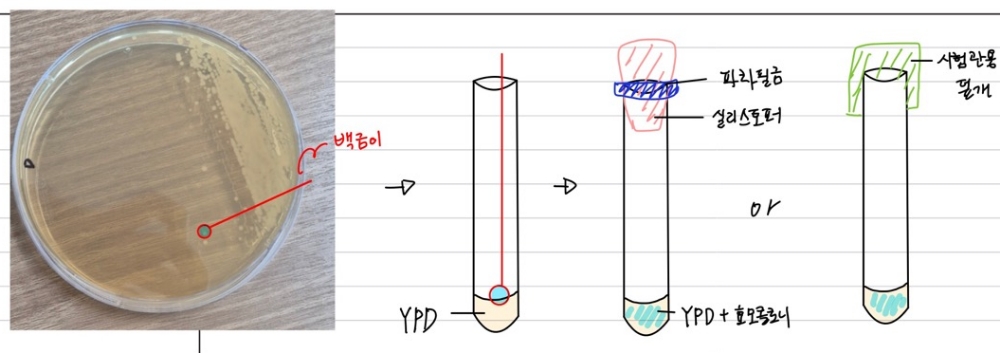
50% 글리세롤 스톡
필요
-글리세린
-DW
-오토클레이브
-메디아병
-메스실린더 등
실험 방법
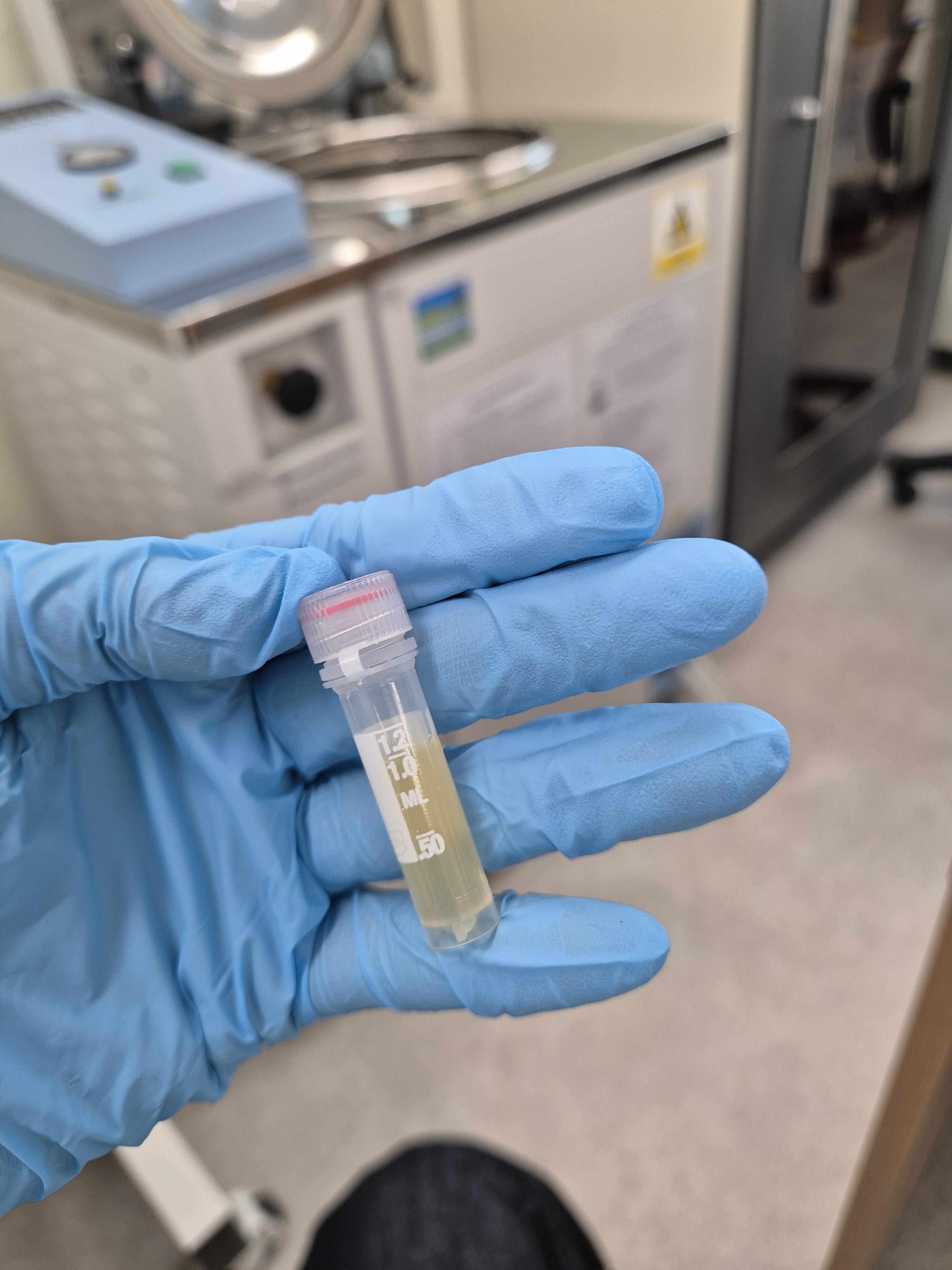
1. (stock) 50% 글리세롤: 베양액 = 8:2 또는 5:5 비율로 넣고 121°C에서 15분간 멸균2. 전배 양 800ul + 멸균 글리세롤 200ul 후 피펫팅
3. 동결건조




잘 섞어주기 
사용 후 실온보관


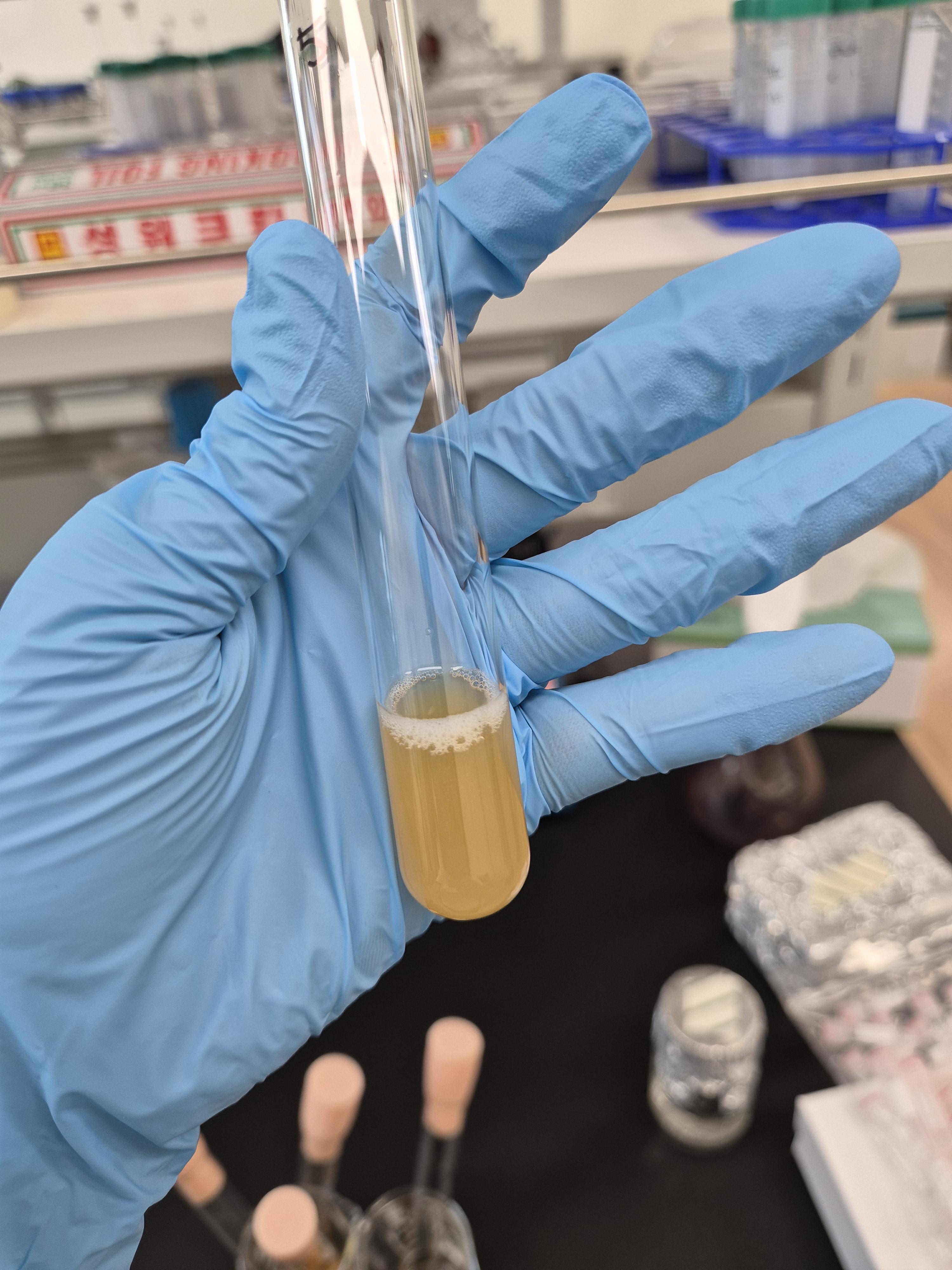
전배 양을 진탕배양한 결과
너무 귀엽게 밑에 바닥에 효모들이 자라 있었다!
(믿고 있었어ㅠㅠㅠ 자랄 거라 믿었다고...ㅜㅜ)
이 효모를 볼텍싱해서 동결건조 하면 끝!


서론
본 연구는 효모를 이용한 생물학적 실험에 초점을 맞추고 있으며, 특히 효모를 활용한 기초 배양 기술 습득과 스톡 제작을 목표로 한다. 이 연구는 기존에 대장균군 배지 제작 경험이 있으나, 효모와 같은 다른 미생물을 다루는 것은 처음이기 때문에, 다양한 논문 검토 및 선배들의 조언을 바탕으로 진행되었다. 효모 배양은 미생물학 연구에서 중요한 기법인데, 이는 미생물의 생장 조건을 이해하고 장기 보관을 위한 스톡을 생성하는 데 필요한 기초 데이터를 제공할 수 있기 때문이다.
재료 및 방법
배지 준비
YPD & YPDA 배지: 효모추출물 10g, 펩톤 20g, 덱스트로즈 20g, 정제수 1L, 아가 15g을 사용하여 배지를 제작한다. 모든 성분을 혼합 후, 오토클레이브를 통해 121°C에서 15분간 멸균한다. 최종 pH 조정 후, 멸균된 용기에 보관한다.
효모 배양
효모 접종: YPDA 배지에 효모 균주를 스트레킹 방식으로 접종하고, 30°C에서 1일간 배양한다.
액체 배지 준비 및 접종: 배양 완료한 고체 배지에서 단일 콜로니를 채취하여 YPD 액체 배지에 접종하고, 16시간 동안 진탕 배양을 진행한다.
확대 배양: 전배양된 샘플의 5%를 100ml 플라스크에 담긴 50ml YPD broth에 접종하고, 30°C에서 24시간 배양한다.
스톡 제작
글리세롤 스톡 제작: 전배양된 효모 배양액과 50% 글리세롤을 8:2 비율로 혼합하고, 이 혼합물을 121°C에서 15분간 멸균한다. 이후, 멸균된 글리세롤과 효모 배양액을 혼합하여 스톡으로 사용한다.
진짜 처음 해보는 거라
너무 많은 시간을 소요했다.
3일이면 되는걸....
몇 번을 실패해서 2주 정도 걸렸으니...
이 스톡을 다시 녹여서 실험을 진행해 보면
잘했는지, 못했는지 알 수 있겠지만
그래도 또 하나의 지식을 쌓을 수 있어서
행복했다!!
'실험방법' 카테고리의 다른 글
[식품 알러젠 키트] 테스트 사용 방법, 결과 해석 방법 (0) 2024.03.07 [용수실험] colilert / colilert -18 정성검사 / 정량검사(방법만) (2) 2024.01.25 [피펫스왑] 3M/ 스왑차이점 및 사용방법 (0) 2024.01.16 [표준평판법 판독방법] (0) 2024.01.09 [황색포도상구균 정성실험 ] (2) 2024.01.09