-
안녕하세요 나칠라 입니다.
오늘은 병원성 미생물 확인시험이 가능한 실험 기기 3M MDS 입니다. (정성검사만 가능)
※ 병원성 미생물 중 (Salmonella, Listeria monocytogenes, Listeria, E.coli O 157)
※ 이 내용은 3M MDS의 메뉴얼, 3M 교육, 휴코에프에스 블로그, 사용 후기로 만들어진 설명입니다.
MDS란?
쉽게 말해서 LAMP 시험법을 이용하여 신속하고 실시간으로 확인 할 수 있는 장치입니다.
※ LAMP 시험법: 등온 DNA증폭과정 + 생물발광
실험 방법 ( 글 설명)
1. 샘플 전 배양 단계 (샘플 25g + 멸균된 증균배지225ml 혼합)
2. 배양 후 3M Lysis tube Capping Tool 이용하여 한 줄 뚜껑 열기.
3. 1번에서 진행한 샘플을 20ul를 Lysis Tube 균주
4. 3M Heating Block Insesrt를 heating unit에 넣는다. (100 ºC)
5. Lysis tubes의 랙을 히팅블럭에 빼내어 5분간 냉각 (분홍색 →노란색)
6. regent tubes와 1개의 Control tube를 랙에 넣고 툴을 사용하여 캡을 열어준다.
7. 냉각완료된 lysis tube에서 시료를 20ul 취하여 reagent tubes에 넣어준다.
8. 완료되었으면 speed Loader tray로 옮긴다.
9. 프로그램의 레이아웃과 peed Loader tray 일치하는지 확인 후 뚜껑을 닫는다.
※균주 전 미리 준비해 주기 / 위아래로 흔들기, lysis tube가 상온인지 확인
실험 방법 (상세설명)
전처리
1. 샘플 전 배양 단계 (샘플 25g + 멸균된 증균배지225ml 혼합)
※저는 회사에서 BPW ISO, Demi Fraser를 사용하고 있습니다. 고로 이것에 관해서 작성하도록 하겠습니다.
나칠라 사진첩 
▶ BPW ISO - 살모넬라, 장출혈성대장균 사용
1L에 23.5g을 만들 어라고 나와요. 그래서 저는 4개 분량정도 해서 900ml 증류수와 21.15g을 넣어서 만들어 준답니다.
▶ Demi Fraser - 리스테리아 모노사이토제네스 사용
1L에 55g을 만들어라고 나와요. 그래서 저는 4개 분량정도 해서 900ml 증류수와 49.5g을 넣어서 만들어 준답니다.
이렇게 만든 가루는 오토클레이브에 넣어서 액체배지로 만들어 줍니다.

출처: 식품공전 


저는 40 ºC정도 됐을 때 시료 25g과 만들어둔 액체배지 225ml을 넣고 해당 온도에 맞는 배양기에 전처리를 해줍니다!
(약 40 ºC인 이유는, 식품공전에서 미생물 실험 중 표준한천배지의 온도를 기준으로 삼아서 실험했기 때문.)
2. 배양 후 3M Lysis tube Capping Tool 이용하여 한 줄 뚜껑 열기.
3. 1번에서 진행한 샘플을 20ul를 Lysis Tube 균주Lysis 튜브 위 아래로 기포 안생기게 흔들어주기


배양 후 3M Lysis 튜브를 갈고리 모양 Tool을 사용하여 뚜껑을 열어주고,
Lysis튜브에 샘플용액을 20ul 균주.
※ Lysis 용액을 살살 위아래로 흔들어준다.
※ Lysis 용액을 상온에 미리 꺼내둔다.
( 중앙에 바로 균주가 어려운 사람들은 벽면에 대고 균주를 하게 되는데, 이때 오차가 크게 안나게 하기위함. 즉, 튜브벽면에 물기를 만들어주어 부드럽게 샘플을 흘려보내기 위함)
4. 3M Heating Block Insesrt를 heating unit에 넣는다. (100 ºC)
5. Lysis tubes의 랙을 히팅블럭에 빼내어 5분간 냉각 (분홍색 →노랑색)
히팅
가열전- 분홍색
가열후- 노랑색미리 100ºC로 예열된 Heating Block에 넣어 15분간 가열시켜 줍니다. (Start 누르면 자동으로 15분 작동.)
※ 시계모양을 눌러주시면 시간이 얼마큼 남은지 알 수 있습니다.
※가열 중 분홍색 Lysis용액은 노란색으로 바뀝니다.
※ 5분간 냉각 과정 때, 튜브를 여기다가 넣어준다. (하늘색 튜브 틀 전체다 같이 넣어주면 됨)

냉각틀
6. regent tubes와 1개의 Control tube를 랙에 넣고 툴을 사용하여 캡을 열어준다.

control tube를 랙에 넣는다.
이때 튜브를 넣는 순서를 추천하자면,
NC > 시료들 > RC 순으로 넣는 것이 좋다. (NC, RC를 가장 멀리 두기)
(이유는, RC는 무조건 양성판정이 나오게끔 만들어졌기 때문에
음성이 나와야 된다. 여기서 RC조각이 다른 튜브들에게 간접오염이 되면
실험의 정확성이 떨어지기 때문이다.)
7. 냉각완료된 lysis tube에서 시료를 20ul 취하여 reagent tubes에 넣어준다.
제가 맘이 급해서 거품이 많이 났는데, 거품이 나면 정확한 실험 결과가 나오기 어려워요! 
lysis용액은 7mm쯤에서 취한다.
(저해물질이 lysis튜브 밑으로 가라앉기 때문.
거품이 나지 않게 살살 녹여준다.
(저처럼 막 하시면 앙대요...ㅜ)※NC, RC에 샘플을 넣는 것이 아니고, 공배지를 넣어야 된다. (각각 다른 팁 사용)
(공배지 만들기- 따로 판매하는 것을 구매하거나, 배지를 아주 적은 양을 다시 만들거나, 전날 실험하고 남은 배지를 UV 등을 쬐게 하며 다음 실험날까지 보관하는 방법이 있다.)
8. 완료되었으면 speed Loader tray로 옮긴다.
9. 프로그램의 레이아웃과 speed Loader tray 일치하는지 확인 후 뚜껑을 닫는다.
톨을 반대로 돌려 뚜껑을 닫아준다.

프로그램 레이아웃과 tray에 있는
튜브들이 일치하는지 확인!10. 뚜껑을 닫으면 바로 런 시작.


실험방법(프로그램 사용방법)
※https://blog.naver.com/PostView.nhn?blogId=hukofs&logNo=221534097159 참고 (휴코에프에스)

로그인 하기
처음 로그인 시 아이디, 비번 동일 (admin이었음)
▶ 새 런 설정
▶ 구성된 런 시작
▶런 결과 보기
▶보고서 생성
▶관리
▶ 사용 설명서
이중에서 새 런 설정 을 누른다.
▶RC: 양성판정 (무조건)
▶NC: 음성판정
▶빈동그라미: 샘플
빨간 저장 디스크를 눌러서 저장하기
(저장된 레이아웃은 프로그램을 나가도 저장되어 있음.)
speed loader tray 와 동일하게 균명, 샘플, RC, NC
정확하게 레이아웃 한다.
(출처: 휴코에프에스 블로그)
기기가 준비중 - 주황색 (미리 켜 놓는 것을 추천)
기기 준비 완료- 초록색(런 버튼을 누르면 뚜껑이 뿅 열림.)
진행중- 파랑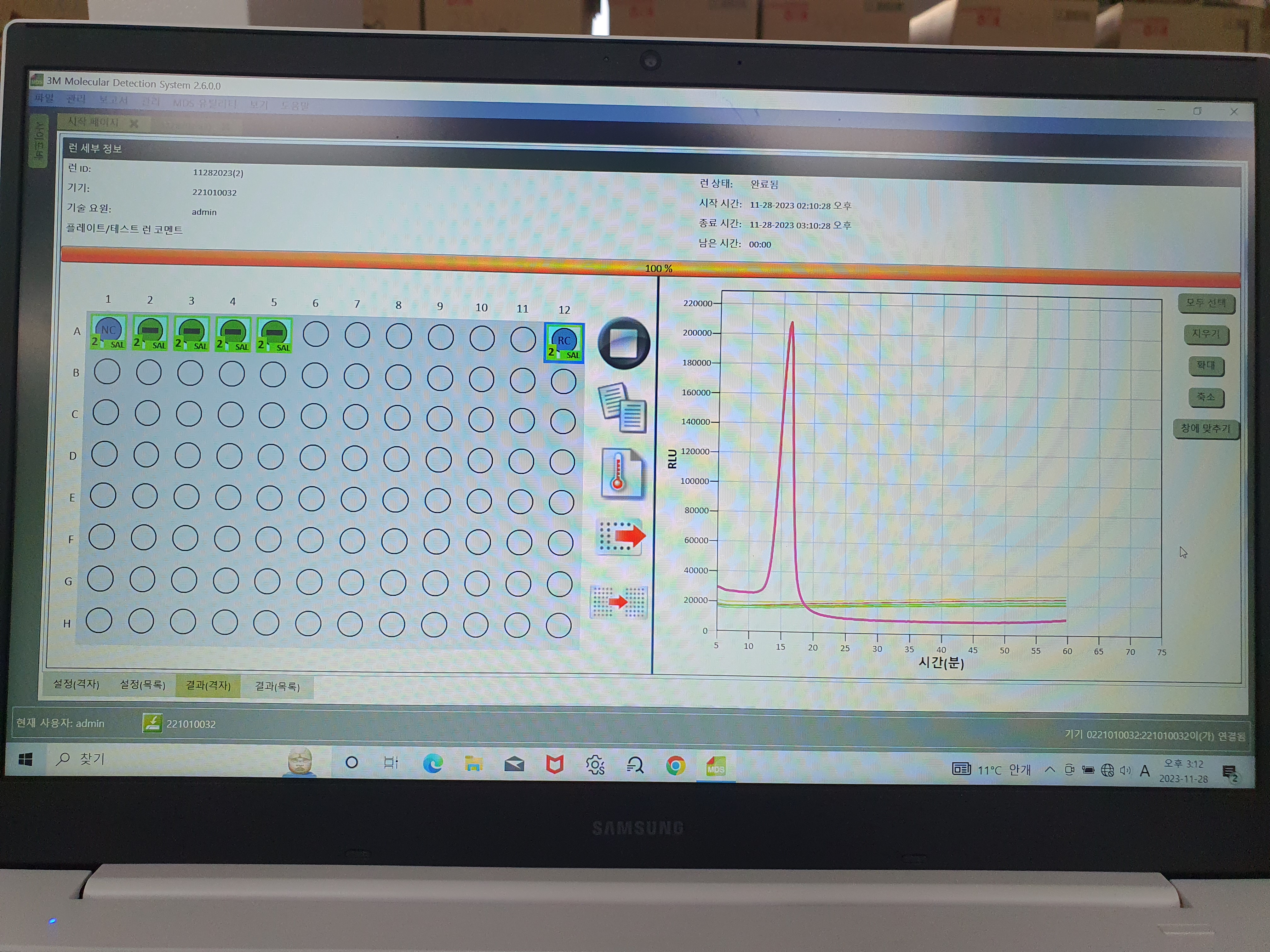
완료된 프로그램 모습
★제가 까먹을까 봐 포스팅을 했는데, 궁금한 점 있으신 분은 편하게 물어봐 주세요!
혹시 제 방법이 틀렸다고 하시는 분은.... 저도 가르쳐 주세요!!! 제발요ㅜㅜㅜ
저도 혼자 실험실을 운영하면서 모르는 게 너무 많은 햇 병아리입니다..ㅜㅜㅜ'실험방법' 카테고리의 다른 글
[표준평판법 판독방법] (0) 2024.01.09 [황색포도상구균 정성실험 ] (2) 2024.01.09 [일반세균수] 실험준비물, 배지 및 사용시약구매, 검채채취방법 (1) 2023.12.22 [희석액이란?] (멸균)생리식염수, 인산완충용액,TWEEN80 (0) 2023.12.19 [PDA배지 만들기] (0) 2023.12.18